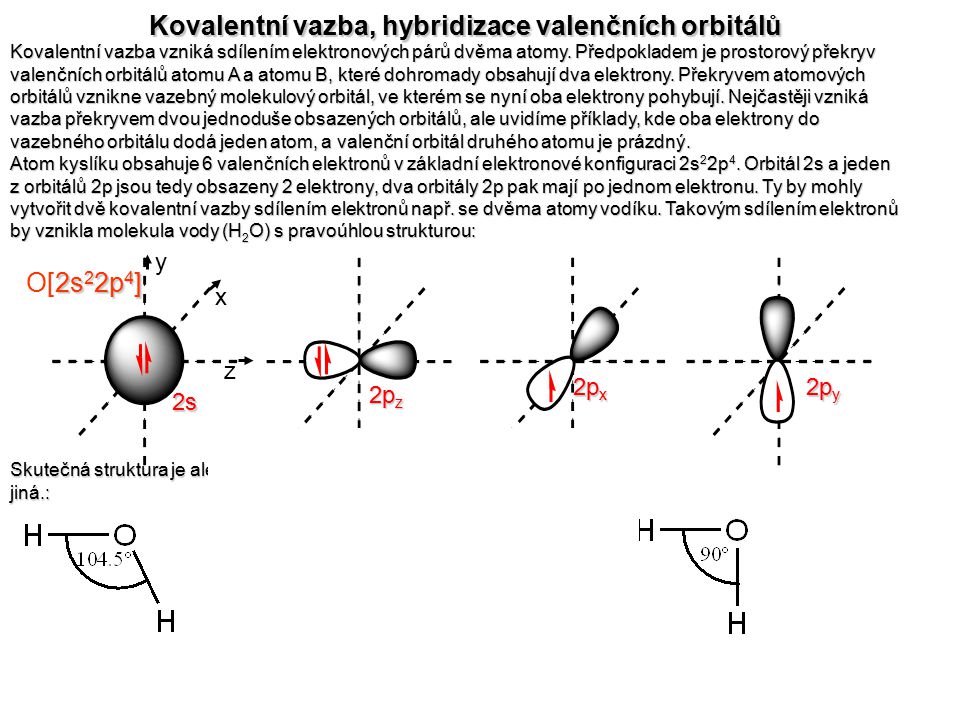
Kovalentní vazba je založena na sdílení elektronového páru, na jehož vzniku se podílí každý atom jedním elektronem. Uplatňuje se mezi atomy nekovových prvků , nejjednodušší je příklad molekuly vodíku: HH:H H-H, další jednoduché příklady : Cl HCl, NH3. Sdílením dvou případně tří elektronových párů vzniká mezi . Kovalentní vazba (homopolární) je vnitromolekulární forma chemické vazby, kterou lze charakterizovat sdílením jednoho nebo více párů elektronů mezi. Energie kovalentní vazby je větší, než energie intermolekulárních vodíkových vazeb.
Jako příklad lze uvést vazbu mezi atomy vodíku a kyslíkem v molekule vody.

Pokud dojde k překrytí jen dvou valenčních orbitalů, vznikne jednoduchá vazba společným sdílením jednoho vazebného elektronového páru. Mezi určitými prvky, ať. Příklady vaznosti některých prvků: Vodík, halogeny.
Podle polarity kovalentní vazby – polaritu chemické vazby určujeme na základě rozdílu. V molekule vodíku jsou protony vázány dvojicí sdílených elektronů ( kovalentní vazba ). Kterýkoliv z elektronů může být nalezen kdekoli ve vyznačené oblasti na obr. Pro vzdálenost protonů a disociační energii dostáváme: a. X („delta iks“) –rozdíl elektronegativit vázaných atomů.
VAZBA KOVALENTNÍ NEPOLÁRNÍ.
Typický příklad jsou molekuly prvků kde ∆X = O. Příslušné molekuly neprojevují navenek elektrický náboj. Tento materiál byl vytvořen v rámci projektu Gymnázium Sušice – Brána vzdělávání II. CH-Obecná chemie, DUM č. Vazby v koordinačních sloučeninách (koordinačně kovalentní vazba ). Popis kovalentní vazby v předchozí kapitolce je obrazem ideální reakce, za vzniku ideální vazby.
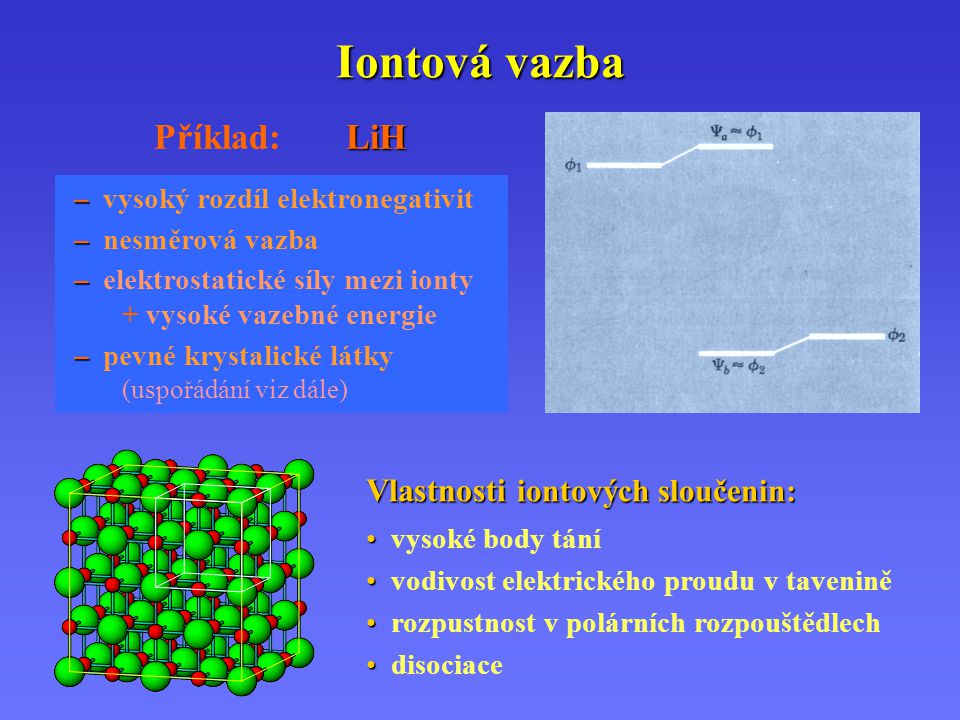
Iontové vazby jsou extrémním příkladem polárních vazeb. Příkladem nepolárních sloučenin jsou uhlovodíky. V těchto sloučeninách se vy- skytují pouze atomy uhlíku C (X = 50) a vodíku H (X = 20). Vypočítáním rozdílu hodnot elektronegativity těchto prvků (∆X = – = 30) je mož- né ověřit, že se skutečně jedná o nepolární kovalentní vazbu.
Polární vazba se nachází . Koordinačně kovalentní – je zvláštním typem kovalentní vazby. Oba elektrony zprostředkující vazbu poskytuje pouze jeden z atomů – má ve valenční vrstvě volný elektronový pár (dusík, kyslík). Atom, který poskytuje pro tuto vazbu volný elektronový pár, se nazývá DONOR (dárce) el. Pokud se rozdíl hodnot elektronegativity Δχ pohybuje v intervalu – je elektronová hustota rovnoměrně rozdělena mezi oba vazební partnery a vzniklou vazbu označujeme jako nepolárně kovalentní. Pokud je rozdíl hodnot elektronegativity v intervalu – dochází k nerovnoměrnému rozdělení elektronové hustoty . Určete jaký druh vazby je v molekule fluoridu vápenatého.
Je však třeba poznamenat, že uvedené rozdělení je pouze hrubé a speciálně mezi silnými vazbami neexistují ostré hranice. Navíc, ve většině reálných struktur se nejčastěji vyskytují smíšené druhy vazeb.
Odborný článek zabývající se chemickou vazbou z pohledu biochemie a vysvětlující pojmy iontová vazba, kovalentní vazba , koordinační vazba, vodíková. Vymezení pojmu chemická vazba a podmínek jejího vzniku. Rozdělení chemických vazeb. Slabší vazebné interakce (vodíková vazba, van der Waalsova vazba). Vlastnosti látek v závislosti na povaze vazby.
POLARITA KOVALENTNÍ VAZBY. Definice chemické vazby a její vznik, disociační a vazebná energie, kovalentní vazba a její klasifikace. Donor musí mít alespoň jeden volný elektronový pár a akceptor alespoň jeden volný orbital. Vazba vzniká sdílením elektronového páru donoru oběma prvky.
Takto vzniklá sloučenina . Pro představu o jak velké energie a vzdálenosti mezi atomy se jedná, uvádíme několik příkladů (o energiích a délkách vazeb se hovoří v systematické části v souvislosti s konkrétní skupinou prvků): molekula.