Vzniká obsazením molekulového orbitalu sigma. Její elektronová hustota je největší na spojnici jader atomů. Vznik vazby je podmíněn obsazením vazebného molekulového orbitalu.
Tento orbital je charakterizován velkou elektronovou hustotou na spojnici dvou atomových jader atomů účastnících se dané vazby. Tato vazba je nepohyblivá a vzniká při přechodu elektronů z atomových orbitalů do .

Dělení kovalentních vazeb podle násobnosti. Väzbový elektrónový pár patrí výlučne elektronegatívnejšiemu atómu. KOVALENTNÍ VAZBA SIGMA A KOVALENTNÍ VAZBA PÍ. Rozdělení chemických vazeb. Obsazením molekulového orbitalu pí vzniká vazba pí, jejíž elektronová hustota je největší mimo spojnici jader a je symetricky rozložena mimo spojnici jader.
Vazba pí vzniká až po vzniku vazby sigma a podílí se na vzniku násobných vazeb. Je také slabší než vazba sigma , proto sloučeniny s násobnou vazbou jsou. Koordinačně kovalentní (dativní, semipolární).
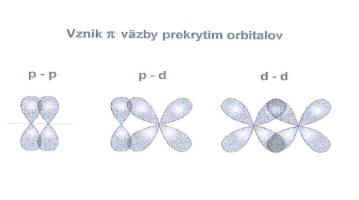
Polarita: je dána rozdílem elektronegativit atomů. Elektronegativita: vlastnost . Překryv dvou p orbitalů. Systém elektronů π je u trojné vazby válcově symetrický. Trojná vazba: 1x sigma, 2x pí. Dvojná vazba je:1x sigma, 1x pí;.
Přednostně vzniká vazba sigma. Chemické väzby z hľadiska rozloženia elektrónovej hustoty. Spojnici jader obvykle značíme jako osu z. DLE ROZLOŽENÍ ELEKTRONOVÉ HUSTOTY. Vysvětlení jednoduchých vazeb v organických sloučeninách. Chemie, Organická chemie, Základy organické.
Jak vypadají násobné vazby v organických sloučeninách? Určete jaký druh vazby je v molekule fluoridu vápenatého. Zatímco sigma vazba je přímo mezi středy daných atomů, tvořících vazbu, π-vazba prochází mimo spojnici středů.
Právě dvojnou, nebo spíše obecně násobnou, vazbu zajišťují překryvy p orbitalů, které se proto nepodílí na hybridizaci.