Atomy, účastnící se vazby, si tímto způsobem zaplňují valenční vrstvu elektronového obalu. Energie kovalentní vazby je větší, než energie intermolekulárních . Hodnoty elektronegativity atomů jednotlivých prvků je možné nalézt například v periodické soustavě prvků. KLÍČOVÁ SLOVA: nepolární, polární kovalentní vazba , iontová vazba, kovová vazby, elektronegativita.
Atomové orbitaly a elektronové hustoty.

Kovalentní vazba se vytváří mezi atomy, jejichž rozdíl hodnot elektronegativity. Podle polarity kovalentní vazby – polaritu chemické vazby určujeme na základě rozdílu elektronegativity atomů tvořících chemickou vazbu. Elektronegativita – schopnost atomů přitahovat elektrony v chemické vazbě – značí se X. Atomy vodíku – chybí elektron do plného zaplnění elektronové slupky.
Atom kyslíku – chybí elektrony . Vznik vazby a její charakteristiky. Van der Waalsova mezimolekulová síla.

Stanovení vazebného mechanismu . Vazba vodíkovým můstkem. V případě této vazby není elektrický náboj v molekule rozložen symetricky a molekula má tak charakter dipólu. K čistě kovalentní vazbě dochází např. Donor musí mít alespoň jeden volný elektronový pár a akceptor alespoň jeden volný orbital. Takto vzniklá sloučenina . Reakční a slučovací tepla (entalpie) osmnáctielektronové pravidlo.
Lewisovy vzorce chemických reakcí. Stručný nástin teorie valenčních vazeb 1. Ostatní energetické změny. Chemická vazba atomů – vazebný elektronový pár je sdílen mezi oběma prvky vazebného páru. Vzdělávací obor: Chemie.
Tematický okruh: Obecná chemie. Cvičení mohou být využita k dílčímu zkoušení. Pojmy: vazba kovalentní , iontová, kovová, vazebné interakce, vodíkový můstek, van . U koordinačně kovalentní vazby poskytuje jeden z reagujících atomů volný elektronový pár.
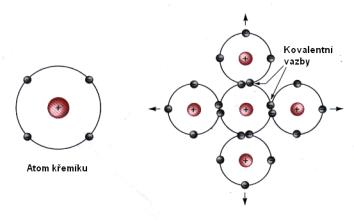
Druhá částice se ale jen „neveze“, . Překrytí valenčních orbitalů. Vytvoření vazebných elektronových párů. Vymezení pojmu chemická vazba a podmínek jejího vzniku. Rozdělení chemických vazeb.
Slabší vazebné interakce (vodíková vazba, van der Waalsova vazba). Koordinačně – kovalentní vazba. Vlastnosti látek v závislosti na povaze vazby. CH-Obecná chemie, DUM č.