Kovová vazba je specifický typ chemické vazby, která se ustavuje mezi atomy kovů. Označení kovová vazba vychází z představy moderní teorie kovů, podle které valenční elektrony atomů tvořící kov jsou volně sdílené mezi všemi atomy, takže kovové ionty jsou obklopeny a prostoupeny jakýmsi „elektronovým plynem“. Kovová väzba existuje medzi atómami kovov v tuhom skupenstve.
Katióny kovov kmitajú okolo rovnovážnych polôh a väzbové elektróny sú delokalizované po celej štruktúre kovu – vytvárajú tzv. Treba ju považovať za typ kovalentnej väzby, ktorej väzbové elektróny sa pohybujú v oblasti jadier všetkých. Vznik vazby a její charakteristiky.
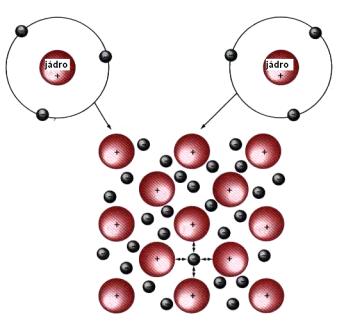
Vazba vodíkovým můstkem. Van der Waalsova mezimolekulová síla. Stanovení vazebného mechanismu . U kovové vazby nejsou tvořeny z atomů molekuly, ale kationty jsou pevně uspořádány do krystalové mřížky mezi nimy se volně pohybují valenční elektrony ve formě tzv.
Kovy mají společné vlastnosti specifické pro tuto skupinu látek, jako je lesk, tažnost, kujnost, neprůhlednost, . Pokud dojde k překrytí jen dvou valenčních orbitalů, vznikne jednoduchá vazba společným sdílením jednoho vazebného elektronového páru. Mezi určitými prvky, ať již stejnými, jako. Iontová vazba, založená na elektrostatickém přitahování opačně nabitých iontů ( NaCl).
Kovalentní vazba, která vzniká sdílením jednoho nebo více valenčních elektronů (Cl2).

Zápis valenčních elektronů v Lewisově symbolice . Právě na základě tohoto faktu lze vysvětlit základní vlastnost kovů, tedy vodivost. Elektrický proud vlastně jen usměrněný pohyb elektronů, a tudíž v prostředí s tolika volnými elektrony dochází k dalšímu vedení proudu, tedy k jejich . PROSTOROVÁ STAVBA MOLEKUL -dvojatomová molekula- tvar -víceatomové . Vysvětlení chemických vazeb podala až kvantová teorie ve 20. Od té doby se datuje vznik kvantové chemie.
Rozlišují se dva základní typy chemických vazeb: 1. Kromě těchto vazeb existují i vazby přechodného typu a . Poněkud jiným způsobem se mezi sebou vážou atomy kovů. Vytvořme si tuto představu: atomy kovu zbavíme valenčních elektronů a rozmístíme je do krystalové mřížky. Protože vzniklý útvar musí být elektroneutrální, odebrané elektrony vrátíme mezi kationty kovu, kde se budou volně pohybovat. Zuzana Szocsová V porovnaní so zlúčeninami , ktoré majú vo svojej štruktúre iónové alebo kovalentné väzby , sa kovy vyznačujú rozdielnymi vlastnosťami. Všetky kovy, okrem ortuti Hg, sú pri bežných podmienkach tuhé látky.
Domů Zboží Hledání zboží: kroužková kovová vazba. KLÍČOVÁ SLOVA: nepolární, polární kovalentní vazba, iontová vazba, kovová vazby , elektronegativita.